Spettri di emissione
|
a) |
Quando un atomo viene portato in uno stato cui corrisponde un eccesso di energia rispetto al suo stato fondamentale, l'atomo emette istantaneamente l'energia assorbita sotto forma di radiazioni di determinata frequenza e ritorna allo stato normale. |
|
b) |
Se le radiazioni emesse da un grande numero di atomi di uno stesso elemento vengono raccolte su una lastra fotografica, non si ottiene uno spettro continuo, corrispondente a radiazioni di tutte le possibili lunghezze d'onda, ma uno spettro a righe (o bande); si notano cioè alcune linee isolate corrispondenti a radiazioni di particolare frequenza. Se si usano ellementi diversi (cui corrispondono atomi diversi) si ottengono spettri di emissione diversi. |
|
c) |
Il fenomeno dell'assorbimento e della successiva emissione di energia da parte dell'atomo eccitato, può essere così schematizzato: 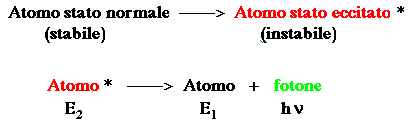
Per il principio della conservazione dell'energia, l'atomo eccitato se isolato emette l'energia assorbita come quanti di luce (Max Plank): Quella che segue è una chiara rappresentazione pittorica del fenomeno dell'assorbimento e dell'emissione di energia radiante qualora non intervenissero altre problematiche di diseccitazione termica: 
Il fenomeno dell'eccitazione può avvenire per altre vie oltre che per assorbimento di energia radiante (es. calore, urti con altre particelle etc..) e risulta soggetto a determinate regole prese in considerazione da Bohr. |
Un po' di più sugli spettri di emissione
Alcuni esempi di spettri di emissione
Dagli spettri di emissione alla deduzione del modello di BOHR
|
a) |
Nell’atomo sono possibili solo alcuni determinati stati energetici e poiché ogni tipologia di atomi da origine ad un particolare spettro, questi stati o livelli energetici devono essere caratteristici di ciascuna tipologia di atomi. |
|
b) |
Un atomo può emettere (o assorbire) energia in quantità ben definite che corrispondono a differenze di energia tra livelli energetici che gli sono caratteristici. |
|
c) |
Questo porta ad estendere all’atomo la teoria quantistica di Plank per l’energia radiante e a pensare che l’energia totale dell’elettrone sia quantizzata, ovvero che l’energia dell’elettrone possa assumere soltanto valori definiti e che qualunque variazione dell’energia consiste nel salto da un valore permesso ad un altro egualmente permesso.
|
 |
Nel 1913 Niels Bohr propose un modello per l'atomo di idrogeno, in grado di spiegare lo spettro a righe dell'idrogeno, basato sui seguenti punti: |
- L'elettrone ruota attorno al nucleo in una orbita circolare stazionaria.
- L'energia dell'elettrone è proporzionale alla sua distanza dal nucleo (raggio dell'orbita).
- Ci sono solo un numero limitato di orbite (ed energie corrispondenti) permesse. Questo significa che le orbite e i corrispondenti livelli energetici sono quantizzati.
- Quando la luce viene assorbita, l'elettrone salta da un livello energetico più basso ad uno a più alta energia. Viceversa quando la luce viene emessa.
- L'energia corrispondente alla luce assorbita od emessa corrisponde alla differenza di energia corrispondente ai livelli energetici dai quali l'elettrone passa.