Lo stato gassoso *
Ancora sui gas reali
L'equazione di van der Waals prevede, al di sotto della temperatura critica di un gas reale, tre valori di pressione per un unico valore di volume. In realtà quello che si verifica per valori di temperatura inferiori alla critica è la liquefazione dell'aeriforme (vapore) per semplice compressione (piano di colore arancio come zona di equilibrio tra le due fasi ora presenti).


La figura che segue mostra il caso specifico del diossido di carbonio:

Al di sopra di una certa temperatura, diciamo maggiore di 50-60°C, le isoterme risultano praticamente dei rami di iperbole equilatera (comportamento quasi ideale). Per temperature inferiori gli andamenti tendono deviare vistosamente dalla forma iperbolica fino ad assumere un flesso perfettamente orizzontale per l’isoterma relativa alla temperatura che viene indicata come temperatura critica (curva colorata in rosso). Al disopra di questo valore di temperatura (curve azzurre) non è possibile liquefare il gas per semplice compressione, mentre per temperature inferiori, la compressione del gas (detto vapore) produce la formazione di CO2 liquida (piani arancione).
Consideriamo, ad esempio, la curva indicata con “<31°C” e supponiamo di trovarci nella zona lato "vapore". Comprimendo il gas si percorre la isoterma da destra verso sinistra; quando si entra dentro la campana tratteggiata in grigio comincia la liquefazione e, lungo tutto il piano colorato in arancione, avremo la contemporanea presenza del liquido e del suo vapore saturo. Per ulteriore compressione si raggiunge il limite sinistro della campana ed in quel punto tutto il gas è diventato liquido. Da questo momento in poi occorrerà aumentare di molto la pressione per ridurre di pochissimo il volume del liquido (pendenza elevatissima della curva "liquido").
NOTE Sui gas:
Simulazione delle distribuzioni di velocità (Maxwell-Boltzmann)(link applet java, non più esistente)
parametri ottimali per la simulazione precedente
number of atom: 100
Mass : 4
Diameter: 0.70
Temperature: non modificare
Mad speed=3*rms: non modificare
Distribuzione delle velocità in funzione della Temperatura (File excel)
Distribuzione delle velocità in funzione delle masse molari (File excel)
DENSITA' DEI GAS
Il principio di Avogadro afferma che volumi uguali di gas diversi nelle stesse condizioni di temperatura e pressione contengono lo stesso numero di particelle. Pertanto, se nello stesso recipiente (stesso volume) si misura la massa di due gas nelle stesse condizioni di temperatura e pressione, il rapporto delle masse ottenute risulterà uguale al rapporto delle densità ed equivale anche al rapporto delle masse delle singole particelle.
Per un gas a comportamento ideale:
| P V = | m PM |
R T |
Isoliamo la pressione per evidenziare la densità del gas:
| P = | m V |
1 PM |
R T |
da cui:
|
|
per due gas A e B nelle stesse condizioni di temperatura e pressione
|
|
Pertanto:
dA dB |
= | PMA PMB |
Ovvero: la densità relativa del gas A rispetto al gas B corrisponde al rapporto tra i pesi molecolari dei due gas.
Decomposizione e/o dissociazione termica
Alcuni gas, già a temperature non troppo elevate ed altri a temperature fin troppo basse (es. AsCl5), tendono a produrre specie derivanti dalla rottura di particolari legami presenti nella molecola. In molti casi la dissociazione presenta carattere di reversibilità e conduce all'instaurarsi di un equilibrio il cui grado di avanzamento risulta dipendente dalla temperatura. Tratteremo la miscela gassosa derivante dalla dissociazione come un sistema "miscela di gas ideali".
Dal punto di vista analitico possiamo schematizzare la dissociazione nel modo seguente
AB 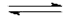
A + B iniziali 1 - - si dissociano α - - si formano - α α equilibrio 1 - α α α per n0 moli n0 (1-α) n0 α n0 α
Il caso descritto consiste in una dissociazione dalla quale si formano un numero moli pari al doppio di quelle che si sono dissociate. Pertanto il numero di moli totali può essere determinato come funzione del grado di dissociazione:
Una dissociazione termica può essere interpretata considerando un recipiente vuoto dentro il quale si inserisce una certa quantità di gas AB. Successivamente, in funzione della temperatura, si verifica la dissociazione. Un aumento di temperatura provoca un aumento del grado di dissociazione e, di conseguenza, si osserverà un aumento del numero di moli di particelle gassose. Il processo di incremento della temperatura può verificarsi a pressione costante o a volume costante.
 |
Aumento della temperatura a volume costante. |
 |
|
In qualunque modo si sia arrivati allo stato (2) si avranno dei ben definiti valori di Temperatura, Pressione, Volume ed un determinato valore per il grado di dissociazione. Se è possibile considera ideale il comportamento della miscela gassosa sarà:
Isoliamo la pressione per evidenziare la densità della miscela gassosa:
| P = | m0 V |
(1+α) PMAB |
R T |
dove "V" è il volume occupato dalla miscela di gas, "n0" è il numero di moli iniziali del gas AB ora sostituto dal rapporto tra la massa iniziale del gas "m0" e il suo peso molecolare "PMAB". La densità della miscela gassosa vale:
| d = | m0 V |
= | P PMAB R T (1+α) |
L'espressione usata in precedenza per ricavare il peso molecolare del gas che non si dissocia:
| PM = | d | R T P |
se usata in questo caso, fornisce un peso molecolare più piccolo di quello del gas AB e che corrisponderà con il PM medio tra le specie AB, A e B, e quindi dipendente dalla composizlione della miscela. Il PM medio risulta pari al rapporto PMAB/(1+α):
| PMmedio = | d | R T P |
= | PMAB (1+α) |
Ciascun gas della miscela, alla temperatura dell'esperimento, contribuirà alla pressione in funzione del numero di moli con cui è presente, ovvero, come recita la legge di Dalton, proporzionalmente alla sua frazione molare. Indicando con n0 il numero di moli che inizialmente sono state introdotte del gas indissociato e con α il grado di dissociazione avremo
| χA = | n.moli A n.moli totali |
= | n0 α n0 (1+α) |
= | α 1+α |
| χB = | n.moli B n.moli totali |
= | n0 α n0 (1+α) |
= | α 1+α |
| χAB = | n.moli AB n.moli totali |
= | n0 (1-α) n0 (1+α) |
= | 1-α 1+α |
pertanto
| Kp = | PA PB PAB |
= | χA P χB P χAB P |
= | P | χA χB χAB |
= | P | α2 1 - α2 |
Consideriamo un esempio in cui la stechiometria del processo è differente:
2 AB 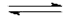
2 A + B2 iniziali 1 - - si dissociano α - - si formano - α α/2 equilibrio 1 - α α α/2 per n0 moli n0 (1-α) n0 α n0 α/2
In questo caso
le tre espressioni precedenti relative alle frazioni molari diventano:
| χA = | n.moli A n.moli totali |
= | n0 α n0 (1+0.5 α) |
= | α 1 + 0.5 α |
| χB = | n.moli B n.moli totali |
= | n0 α n0 2 (1+0.5 α) |
= | α 2 + α |
| χAB = | n.moli AB n.moli totali |
= | n0 (1-α) n0 (1+0.5 α) |
= | 1 - α 1 + 0.5 α |
Vista la relativa complessità formale delle espressioni ottenute non è conveniente sostituirle nella formula della costante di equilibrio. È meglio ricavare il relativo valore numerico e sostituirlo
| Kp = | PA2 PB PAB2 |
= | P | χA2 χB χAB2 |
Conclusione
Per una reazione di decomposizione termica in condizioni di equilibrio ad una certa temperatura, il grado di dissociazione e quindi la composizione della miscela, dipendono dal valore della costante di equilibrio Kp. Se è nota la stechiometria del processo risulta facile correlare le frazioni molari dei componenti al valore del grado di dissociazione e quindi dedurre l'espressione della Kp in funzione della pressione totale del sistema e del grado di dissociazione.