Sia M un metallo che forma ioni con una singola carica positiva (M+). Supponiamo che il sale MA composto da questo metallo e un anione derivante da un acido monoprotico debole HA sia poco solubile e pertanto scriveremo
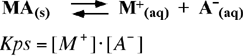 |
(1) |
L'anione A- è la base coniugata dell'acido HA. Se HA è un acido piuttosto forte, tenderà a non formarsi in forma associata, ma se HA è un acido debole si verificherà consistentemente la seguente reazione di equilibrio che sarà tanto più spostato verso destra tanto più elevato è il valore della costante Kb della sua base coniugata
|
(2) |
La formazione di HA indissociato sottrae A- all'equilibrio di solubilità (1) e, di conseguenza, una maggiore quantità di sale MA si deve solubilizzare per ripristinare l'uguaglianza tra il prodotto ionico e il Kps. Il sistema si stabilizzerà quando tutti e due gli equilibri rispetteranno le condizioni dettate dai rispettivi valori di costante di equilibrio.
La prima cosa che si evince da quanto detto è che le quantità [M+] e [A-] non saranno uguali. La quantità totale in moli della specie A che si forma (somma di quella presente in forma anionica A- che in forma associata nell'acido HA) deriva solamente dalla solubilizzazione del sale MA e pertanto deve essere uguale alla quantità in moli di M+, mentre ovviamente, a causa della presenza del secondo equilibrio, le moli di A- rimaste in soluzione saranno inferiori alle molli di M+. La quantità di sale che passa in soluzione è rappresentata da M+, pertanto, in termini di concentrazione sarà [M+] = s ed in definitiva:
| (3) |
Dal punto di vista qualitativo si intuisce che al diminuire del pH (diminuzione di [OH-]) dovrà aumentare la solubilità del sale, infatti si avranno sempre meno ioni idrossido e l'equilibrio (2) verrà forzato verso destra, con conseguente consumo di ioni A- e ciò forzerà ulteriormente l'equilibrio (1) verso destra. Per l'equilibrio (2) possiamo scrivere:
| da cui | ||
| (4) | ||
| ed essendo | ||
la (4) diventa
| (5) |
inserendo la (5) nella (3)
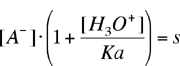 |
||
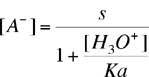 |
(6) |
Infine, l'espressione della costante di equilibrio di solubilità della reazione (1) diventa:
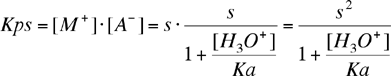 |
da cui :
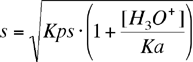 |
(7) |
L'espressione ricavate definisce quantitativamente l'influenza della concentrazione idrogenionica sulla solubilità del sale ed evidenzia anche l'influenza della costante dell'acido debole HA.
Similmente a quanto fatto, è possibile ricavare espressioni più complesse nel caso di acidi poliprotici. Questo è il caso dei solfuri. Ad esempio, per il solfuro di zinco si ricava la seguente espressione:
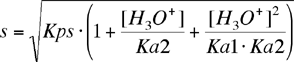 |
Si osservi la maggiore complessità della dipendenza dagli ioni idronio (e dal pH) e dalle due costanti di dissociazione dell'acido solfidrico. Noi ci fermiamo alla prima dimostrazione, quello che segue sarà compito della chimica analitica.
UNA NOTA:
Naturalmente potevano non convertire l'esperssione (4) nella (5) e continuare ad usare [OH-] come riferimento sostituendo direttamente la (4) nella (3):
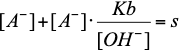 |
||
 |
||
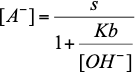 |
(6b) |
Infine, l'espressione della costante di equilibrio di solubilità della reazione (1) diventa:
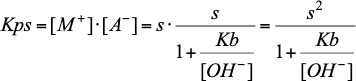 |
da cui :
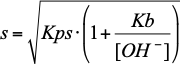 |
(7b) |
L'espressione ricavate è perfettamente valida e definisce quantitativamente l'influenza della concentrazione degli ioni idrossido sulla solulbilità del sale ed evidenzia anche l'influenza della costante della base debole debole A-. In genere si preferisce utilizzare [H3O+] come riferimento.