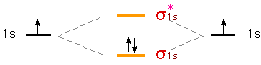Orbitali molecolari (MO-LCAO)
Il problema della distribuzione degli elettroni nella molecola è simile a quello della distribuzione degli elettroni nell'atomo. La differenza è che nella molecola gli elettroni si trovano sotto la contemporanea influenza di due nuclei (caso delle molecole biatomiche).
Il moto degli elettroni nella molecola può essere
descritto per mezzo di una funzione d'onda ![]() che chiameremo Orbitale Molecolare (OM). Il livello energetico dell'elettrone
nella molecola corrisponderà ad un gruppo di nuovi
numeri quantici ed il riempimento degli orbitali molecolari segue gli stessi
principi già visti per gli atomi isolati. (2
elettroni per OM con spin opposto; riempimento a partire da
OM a più bassa energia secondo il principio della
massima molteplicità)
che chiameremo Orbitale Molecolare (OM). Il livello energetico dell'elettrone
nella molecola corrisponderà ad un gruppo di nuovi
numeri quantici ed il riempimento degli orbitali molecolari segue gli stessi
principi già visti per gli atomi isolati. (2
elettroni per OM con spin opposto; riempimento a partire da
OM a più bassa energia secondo il principio della
massima molteplicità)
Così come nel caso degli orbitali atomici, anche nel caso degli Orbitali Molecolari si fa riferimento a metodi approssimati (LCAO).
Secondo il metodo LCAO, nel caso delle molecole biatomiche omonuclerari, l'OM può essere descritto come somma e sottrazione degli orbitali atomici degli atomi isolati
 A1A2
=
A1A2
=  A1
+ c
A1
+ c A2
A2
c = costante, fattore arbitrario scelto per minimizzare
l'energia dell'OM; per molecole simmetriche c = ± 1,
per cui si hanno due funzioni corrispondenti a due orbitali
molecolari uno ottenuto con la combinazione lineare degli Orbitali Atomici
in fase, e l'altro in opposizione di fase.
L'Orbitale molecolare legante, di minor livello
energetico rispetto a quello degli Orbitali Atomici degli atomi
isolati, sarà:
 A1A2
=
A1A2
=  A1
+
A1
+  A2
A2
L'Orbitale molecolare antilegante, di maggior livello energetico rispetto a quello degli Orbitali Atomici degli atomi isolati, sarà:
 A1
-
A1
-  A2
A2
In generale, perché da due orbitali atomici si possano formare OM, si richiedono 2 condizioni:
|
a)
|
Gli orbitali devono avere la stessa simmetria rispetto ad un asse che congiunge i due nuclei (massima sovrapposizione a parità di distanza) |
|
b)
|
I loro livelli energetici non devono essere troppo diversi |
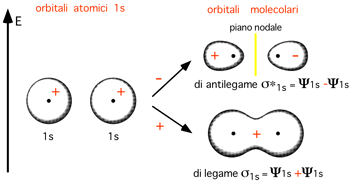
Nella presente trattazione introduttiva ci limiteremo a discutere il semplice caso di molecole biatomiche omonucleari. L'esempio più semplice riguarda la formazione della molecola di idrogeno H2 a partire dagli atomi isolati.
|
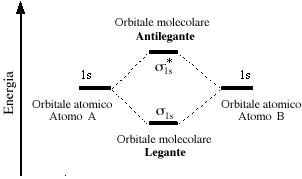
Dalla combinazione lineare di due orbitali atomici si ottengono due orbitali molecolari, uno legante e uno antilegante. Quello di legame permette agli elettroni di spendere gran parte del loro tempo nella regione compresa tra i due nuclei. Quello di antilegame posiziona gli elettroni in zone dello spazio esterne alla regione compresa tra i due nuclei.
Se ora osserviamo l'OM legante dal punto di vista della sua simmetria, ruotando il sistema attorno alla congiungente i due nuclei, notiamo che esso è cilindricamente simmetrico (le sezioni sono costituite da una distribuzione costante e circolare)
Gli OM che possiedono questa simmetria (simmetria sigma: completa identità per rotazione attorno all’asse) vengono chiamati orbitali molecolari ![]() (sigma). Il legame cui danno origine assume la stessa
denominazione.
(sigma). Il legame cui danno origine assume la stessa
denominazione.
Anche l'OM antilegante, pur presentando un piano nodale, risulta cilindricamente simmetrico attorno all'asse di legame, e viene
chiamato ![]() *. Il legame in H2 è quindi di
tipo
*. Il legame in H2 è quindi di
tipo ![]() (precisamente
(precisamente ![]() 1s ) (ESPLICITAZIONE SIMMETRIA IN H2 :
JSmol view
)
1s ) (ESPLICITAZIONE SIMMETRIA IN H2 :
JSmol view
)
Piuttosto che disegnare gli orbitali, spesso si utilizzano grafici schematici per visualizzare l'ordine crescente dell'energia che compete agli orbitali molecolari. Nel caso della molecola dell'idrogeno:
|
Gli elettroni vengono aggiunti uno alla volta partendo dall'orbitale molecolare a più bassa energia rispettando le regole già previste per gli orbitali atomici:
|
Nel caso della molecola di idrogeno, i due elettroni sono posti entrambi nel livello energetico più basso. Il diagramma suggerisce che l'energia della molecola è minore rispetto a quella associata ai due atomi isolati risultando pertanto un sistema più stabile.
Orbitali Molecolari del secondo livello energetico
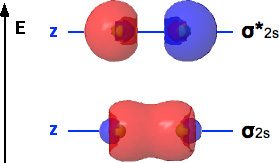
Gli orbitali 2s si combinano, come accade agli orbitali 1s, per formare altri due orbitali molecolari, rispettivamente ![]() 2s e
2s e ![]() *2s. Gli orbitali 2s hanno una sfera nodale interna, pertanto gli orbitali molecolari derivanti dalla loro combinazione lineare assume una forma un poco diversa rispetto agli orbitali molecolairi 1s:
*2s. Gli orbitali 2s hanno una sfera nodale interna, pertanto gli orbitali molecolari derivanti dalla loro combinazione lineare assume una forma un poco diversa rispetto agli orbitali molecolairi 1s:
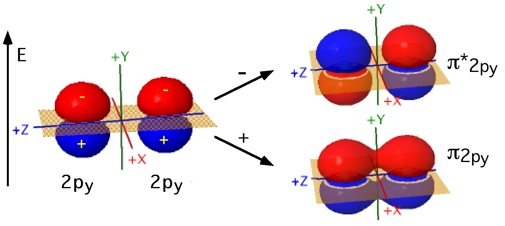
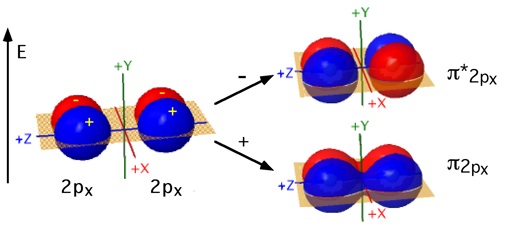
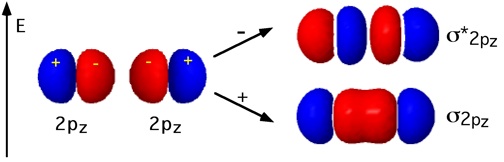
Gli orbitali di tipo 2p, direzionali, possono sovrapporsi
a due a due per formare legami. Indicando arbitrariamente con z la direzione
che congiunge i due nuclei, da due orbitali 2pz che si incontrano frontalmente si
ottengono due orbitali molecolari ![]() pz e
pz e ![]() *pz. Rimangono gli orbitali atomici 2py ed i
2px tra loro ortogonali che si possono sovrapporre lateralmente. Gli Orbitali Molecolari che si formano da questa interazione (
*pz. Rimangono gli orbitali atomici 2py ed i
2px tra loro ortogonali che si possono sovrapporre lateralmente. Gli Orbitali Molecolari che si formano da questa interazione ( ![]() py e
py e ![]() *py
,
*py
, ![]() px
e
px
e ![]() *px
) non sono cilindricamente simmetrici rispetto all'asse
di legame (cambio di segno delle funzioni d’onda per rotazione attorno all’asse).
*px
) non sono cilindricamente simmetrici rispetto all'asse
di legame (cambio di segno delle funzioni d’onda per rotazione attorno all’asse).
|
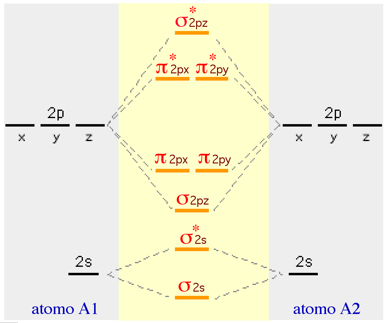
Per il fatto che gli orbitali 2pz si incontrano testa-testa, la loro interazione (sovrapposizione) sarà maggiore rispetto a quella degli orbitali 2py e 2px, pertanto ci aspettiamo la seguente distribuzione energetica:
|
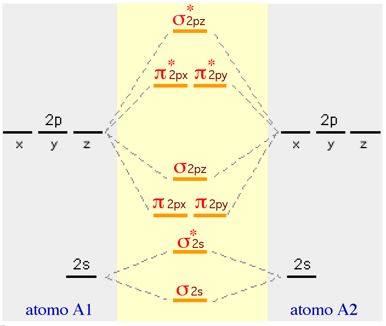
Nel modello precedente, valido per O2 e F2, non si è tenuto conto del fatto che la differenza energetica tra gli orbitali 2p e 2s è molto piccola. Questo fatto produce delle interazioni, specie tra gli orbitali 2s e il 2pz, che modificano la sequenza energetica nel modo seguente:
|
L'inversione degli orbitali molecolari ( ![]() e
e ![]() )
viene interpretata in maniera non omogenea tra i diversi autori, ma la cosa non influenza
minimamente il nostro trattamento qualitativo dell'argomento. Quando si costruisce
la sequenza degli orbitali molecolari, gli orbitali molecolari più interni
(
)
viene interpretata in maniera non omogenea tra i diversi autori, ma la cosa non influenza
minimamente il nostro trattamento qualitativo dell'argomento. Quando si costruisce
la sequenza degli orbitali molecolari, gli orbitali molecolari più interni
( ![]() 1s e
1s e ![]() *1s)
usualmente non vengono presi in considerazione perchè non facenti parte del
guscio esterno di valenza.
*1s)
usualmente non vengono presi in considerazione perchè non facenti parte del
guscio esterno di valenza.
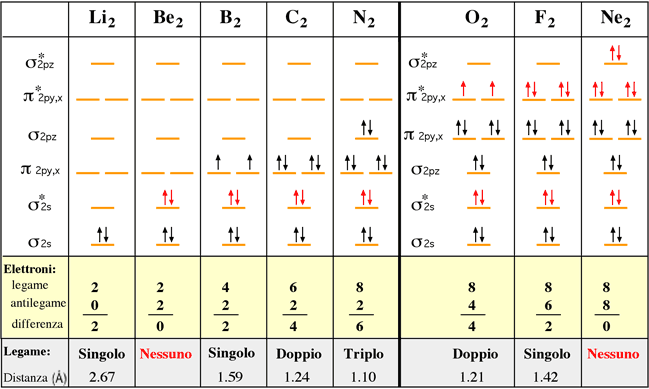
Due esempi di riempimento di orbitali molecolari
(ESPLICITAZIONE SIMMETRIA IN F2 : JSmol view )
Molecular Orbital Viewer (link verso internet)
Orbitali di tipo diverso, ma con energia non troppo diversa, possono combinarsi se si propongono nella giusta direzione che permetta la stessa simmetria attorno all'asse di legame. Tipici esempi sono le molecole NO e CO. Nel nostro corso non discuteremo questo argomento.
Ordine di legame
Il numero di legami che si stabilisce tra una coppia di atomi è detto ordine di legame. Le strutture di Lewis permettono di calcolare l'ordine di legame. L'ossigeno, nella sua molecola, ha un ordine di legame pari a 2. I legami carbonio-carbonio nel benzene hanno un ordine di legame pari a 1.5.
Nella teoria degli orbitali molecolari l'ordine di legame viene calcolato considerando che due elettroni in un orbitale molecolare legante contribuiscono come per un legame netto, mentre due elettroni in un orbitale molecolare antilegante cancellano l'effetto di un legame. In formula:
Uso della teoria per spiegare il perchè alcune molecole non esistono
Esempio 1: He2 non esiste perchè combinando due atomi di elio, si otterrà un sistema con ordine di legame zero. L'eventuale molecola non avrebbe stabilità maggiore dei due atomi isolati.
Esempio 2: Li2 esiste perchè combinando due atomi di litio, si otterrà un sistema con ordine di legame uno. La molecola biatomica avrebbe maggiore stabilità dei due atomi isolati.
Nella tabella seguente vengono proposti altri esempi. Per semplicità sono stati eliminati gli orbitali più interni. Gli elettroni negli orbitali di antilegame vengono evidenziati in rosso.